FDM 3D 프린터를 이용한 몰드 기반의 바이오 세라믹 인공지지체의 새로운 제작 방법
Copyright © The Korean Society for Precision Engineering
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Scaffolds for bone tissue engineering (BTE) should accomplish appropriate mechanical, cell interaction, and new bone in-growth properties. Among calcium phosphate (CaP) based bio-ceramics used for preparing scaffolds, biphasic calcium phosphate (BCP) is attracting great interest for fabricating BTE scaffolds owing to its excellent biocompatibility and osteoconductivity. Fused deposition modeling (FDM) is an additive manufacturing technology commonly used for modeling, prototyping, and production applications. It is one of techniques used for 3D printing. The main purpose of this study was to develop new fabrication process of BCP scaffolds based on extrusion moulding using a 3D printer. Through the 3D printer, we showed new fabrication process for making scaffold mould and extrusion device parts that could be combined with tension-compression test machine. Line width, pore size, and porosity of these fabricated BCP scaffolds were measured and calculated. Mechanical properties and cell proliferation results of these BCP scaffolds were then evaluated.
Keywords:
Bone tissue engineering, Fused deposition modeling, Scaffold, Bio-ceramic키워드:
골 조직 공학, 열 용해 적층법, 인공지지체, 바이오 세라믹1. 서론
조직공학은 손상된 골 조직 또는 생체 기능을 개선 및 복원하기 위한 다학제간의 학문이다. 조직공학에서 중요한 인자로는 세포, 성장인자 그리고 인공지지체가 있다. 이 때, 인공지지체는 세포의 증식 및 분화 그리고 세포들이 골 조직을 생성할 수 있도록 도와주는 중요한 역할을 한다. 이러한 인공지지체는 생체적합성과 생분해성이 필수적이다.1 따라서 최근 인공지지체를 제작하기 위해 다품종 소량생산과 시작품 제작에 장점이 있는 첨가가공(Additive Manufacturing) 기술이 사용되고 있다.2,3
인공지지체에 사용되는 생체재료로는 크게 고분자(Polymer), 세라믹(Ceramic) 그리고 금속(Metal)으로 구분된다. 특정 위치에서 재료를 사용하는 조건의 경우 다음 세 가지 요소인 경제성(Economics), 특성(Properties) 그리고 공정(Processing)을 고려해야 한다. 재료의 물리적 성질은 세라믹, 금속 및 고분자의 순서로 좋으며, 가공은 금속, 고분자 그리고 세라믹 순서로 어렵다.4,5
세라믹 분말은 복잡한 형태의 구조물로 제작하기 어렵고 제조 공정에서의 반복재현성이 떨어진다. 또한 세라믹재료는 깨지기 쉬운 특성이 있다.5,6 하지만, 세라믹 인공지지체의 제조 기술은 많은 가공기술의 진보로 인해 개선되고 있다. 최근에는 3D 프린팅 기술을 이용한 세라믹 인공지지체 제작에 대한 연구가 진행되고 있다. 대표적인 기술로는 선택적 레이저 소결(Selective Laser Sintering), 로보캐스팅(Robocasting), 잉크젯기술(Inkjet-Based 3D Printing) 등이 있다. 하지만 제작 공정이 까다롭고 표면 조도가 좋지 못한 특성을 가지고 있다.7-9
그러나3D 프린팅 기술을 기반으로 몰드(Mould)를 이용한 바이오 세라믹 인공지지체의 제조 사례가 최근 보고되고 있다. 대량 생산에 유리하고 원하는 형상의 몰드를 쉽고 빠르게 제작할 수 있는 몰드 제작 기술에는 광조형기술(Du et al.,9 Sabree et al.,10 Chopra et al.,11 Seol et al.,12 Guo et al.,13 Woesz et al.14), 열 용해적층기술(Bose et al.15), 그리고 쾌속조형기술(Wilson et al.,16,17 Schumacher et al.,18 Vivanco et al.19) 등이 있다. 기존방식에서는 몰드의 형상이 내외부가 막혀져 있지 않은 채로 수작업으로 세라믹 슬러리를 주입하였다. 따라서 본 연구에서는 간편한 몰드 성형방식을 고안하였고, 책상용 압축 시험기를 활용하여 시린지 주사 기능이 될 수 있도록 필요한 부품을 3D 프린터로 제작하였다.
본 연구에서는 FDM 3D 프린터를 이용한 몰드를 기반으로 세라믹 인공지지체의 제작시간을 단축시킴과 동시에 재현성을 증가시키고, CSE (Ceramic Slurry Extrusion) 공정에 대한 새로운 제작방법을 개발하여 손쉽고 편리하게 세라믹 인공지지체를 만들고자 하였다. 또한, 소결 후 만들어지는 세라믹 인공지지체의 정밀도를 향상시키고자 하였다. 실험 몰드 그룹은 세가지 유형으로 구분한다. 그리고 세라믹 인공지지체의 외부 치수 및 무게를 측정하였고 부피, 다공성 및 수축률에 대한 값을 계산하였다.
2. 실험 및 방법
2.1 CSE 공정 설계
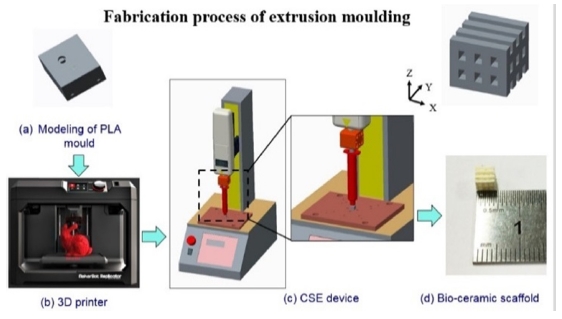
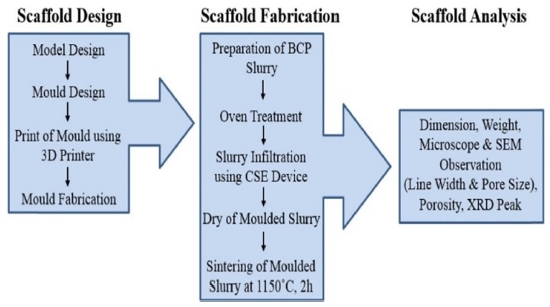
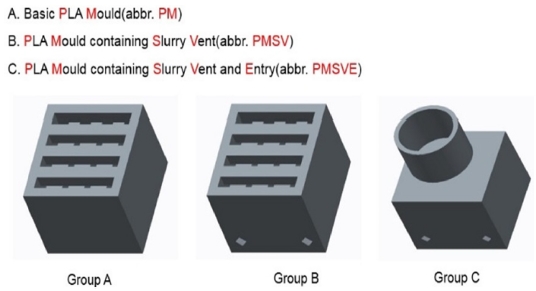
Fig. 1은 CSE 공정의 콘셉트로서 인공지지체를 설계 및 제작하고 평가하는 단계까지 전체과정을 보여준다. 인공지지체를 제작하기 위한 개략도는 Fig. 2에서 나타내고 있다. 간단히 설명을 하면, Fig. 1(a)는 몰드 모델링의 사진이며, 원하는 인공지지체를 제작하기 위해 3D 소프트웨어를 통해 내부 연결성을 가지고 또한 공극이 만들어질 수 있도록 디자인하였다. Fig. 1(b)는 상용화된 3D 프린터이며, 모델링 파일을 STL로 변환하여 제작 조건을 설정하면 빠른 시간 내에 제작이 가능하다. 그리고 나서 자체 개발된 CSE 장치를 통해 몰드를 Fig. 1(c)와 같이 시린지와 결합하고 압출 공정을 수행하였다. 끝으로 오븐에서 건조시킨 후에 소결함으로써 Fig. 1(d)처럼 바이오 세라믹 인공지지체가 제작되었다. Fig. 3은 몰드의 콘셉트 모델링 사진이다. 그룹 A는 일반형 모델로 상부에만 열려있는 형태이고 그룹 B는 그룹 A 모델과 같으나 하부 측면에 양방향으로 총 4개의 출구가 있다. 하부 측면에 양방향으로 4개의 출구가 있는 것은 바이오 세라믹 슬러리를 정량적으로 충진하기 위함이다. 슬러리를 충진하는 과정에서 4곳에서 슬러리가 나오게 되면 몰드 속 슬러리가 모두 충진되었다는 것을 알 수 있다. 그룹 A와 B는 CSE 장치로 사용이 되지 않으며 수작업으로 슬러리를 충진할 수 있다. 그룹 C는 그룹 B보다 정량적인 충진과 더불어 CSE로 슬러리를 충진할 수 있어 수작업보다 효율적이다. 그룹 B와 마찬가지로 하부 측면에 양방향으로 4개의 출구가 있다. Table 1은 FDM 3D 프린터를 사용한 몰드 및 부품의 공정 조건을 나타내고 있다.
2.2 슬러리 준비
이상 인산 칼슘(BCP, 60% HA와 40% TCP의 합성)은 오스젠 회사에서 구입하였다. BCP 분말은 100의 체를 통해 걸러 사용하였다. Bio-Ceramic 입자를 안정화 시키기 위한 분산제로 Polymethacrylate (Darvan®C, RT Vanderbilt, USA)를 사용하였다. Hydroxyprophyl Methylcellulose (HPMC, H7509-100G, Sigma-Aldrich, USA)는 점도를 증가시키기 위해 사용하였고, Polyethylenimine (PEI, 408727-100ML, Sigma-Aldrich, USA)는 응집제로서 필라멘트가 노즐로부터 응집력을 가지고 토출되도록 하는 재료로 사용되었다.20 적절한 배합비율을 맞추기 위해 먼저 분석저울(Ohaus PA214, USA)에 플라스틱 접시를 사용하여 0.8 g의 BCP를 준비하였다. 그리고 나서 0.75 ml의 Darvan®C, 0.1 g의 HPMC 그리고 0.3 ml의 PEI를 넣어 골고루 혼합하였다. 혼합공정 후 제조된 혼합물을 오븐(OF-12, JEIO TECH, Korea)에 50oC에서 20분 동안 건조시켰다. 오븐에서의 열처리는 혼합물로부터 수분을 증발시키고 슬러리를 보다 안정화시키기 위한 필수 작업이다. 그렇지 않으면 슬러리 구조물 제작 시 형상 유지가 제대로 되지 않는다.
2.3 특성
인공지지체의 선폭과 공극 크기를 측정하기 위해 정립 현미경(CX31, Olympus, Japan)이 사용되었다. 그리고 주사전자현미경(Scanning Electron Microscopy, Tescan VEGA II LMU, Czech)을 사용하여 제작된 바이오 세라믹 인공지지체의 구조 및 표면을 관찰하였으며, 에너지 분산형 분광분석(Energy Dispersive X-Ray Spectroscopy)을 통해 재료의 이온 성분을 측정하였다. 소결 전과 후의 세라믹 인공지지체의 회절 X선 스펙트럼을 얻기 위해 CuK, 35 kV, 20 mA의 조건으로 X선 회절 분석(XRD, Ultima IV, Rigaku, Japan)을 진행하였으며, 범위는 2o/min의 속도로 10o에서 80o까지 측정하였다.
3. CSE 공정을 이용한 바이오 세라믹 인공지지체의 제작 및 평가
3.1 바이오 세라믹 인공지지체의 제작 공정
CSE 장치는 FDM 3D 프린터를 사용하여 압축 시험기 및 부품을 통해 성공적으로 개발되었다. Fig. 5는 CSE 장치의 실제 이미지를 보여준다. Fig. 5(a)에서 보면, 국방색의 압축기 헤드와 시린지 피스톤의 연결부가 3D 프린터를 활용하여 제작되었다. Fig. 5(b)를 통해 더욱 세부적으로 결합된 부품을 확인할 수 있다. Fig. 5(c)는 몰드 내부로 슬러리를 압축해서 삽입시키는 공정을 보여주고 있다.
바이오 세라믹 인공지지체 제작을 위한 제조 공정은 다음과 같다. 우선, 준비된 슬러리를 10 cc 주사기로 채우고, 몰드의 입구 부분을 주사기의 테이퍼 노즐과 결합시킨다. 두 번째, 결합 된 주사기를 피스톤 헤드에 연결한다. 세 번째, 피스톤 헤드는 슬러리가 압축 될 수 있는 슬러리 위치로 이동되고, 피스톤 헤드를 20 kgf까지 압축한다. 마지막으로, 슬러리는 4 개의 출구 중 하나의 출구에서 나오게 된다. 결과적으로, 슬러리가 모든 출구로부터 흘러나오게 되면 슬러리의 충전이 몰드에서 마무리 되고, 몰드는 압축장치로부터 제거되며 완성된다. 제작된 몰드형 인공지지체를 12시간 동안 상온에서 건조시키고, 50oC에서 12 시간 동안 오븐에서 건조시킨다. 세라믹 인공지지체를 얻기 위해 소결로(MF-12, JEIO TECH, Korea)를 사용하였다. 온도 제어 과정은 다음과 같이 수행되었다.20 슬러리 구조에 균열이 생기지 않도록 몰드형 인공지지체를 600oC로 소결한다. 소결 동안 몰드의 주재료인 PLA는 모두 사라지고 없어진다. 600oC에서 소결로의 소결온도는 1시간 동안 유지하였다. 그리고 나서 600oC에서 1,150oC로 온도를 올린 뒤, 최종온도 1,150oC로 2 시간 동안 유지하였다. 소결공정에서 몰드가 제거되어 내부 및 모양이 잘 이루어진 세라믹 인공지지체가 만들어졌다. 결과적으로 세라믹 인공지지체는 1150oC에서 2 시간 소성 한 후에 제작되었다.
3.2 바이오 세라믹 인공지지체의 제작 및 평가
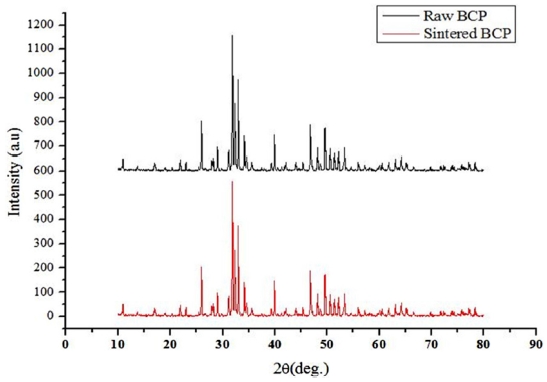
Fig. 6은 소결 전 BCP 분말과 소결 후 세라믹 인공지지체의 XRD 패턴을 보여주고 있다. 소결 전 BCP 및 소결 후 세라믹 인공지지체는 XRD성분 곡선에서 HA (JCPDS No. 09-0432) 및 β-TCP (JCPDS No. 09-0169)에 해당하는 결과값을 나타내었다.22 류외 연구자들(Ryu et al.)에 따르면, 상온에서 β-TCP 상이 가장 안정하다는 것을 보고했었다. 따라서, 본 연구에서는 β-TCP상을 얻기 위해 1,150oC 온도로 소결을 진행하였다. 그 결과, 모든 세라믹 인공지지체에서 1180oC 이상에서 얻을 수 있는 α-TCP 상을 관찰할 수 없었다.
Fig. 7은 1150oC에서 2시간 동안 소결된 세라믹 인공지지체의 SEM 사진이다. 세라믹 인공지지체는 고온 소결 공정을 거친 후 얻어졌으며, Fig. 7(a)에서 볼 수 있듯이 세라믹 인공지지체는 몰드의 잔재물이 없이 깨끗한 겉표면을 보여주고 있었다. 세라믹 인공지지체의 등각 투시도와 평면도의 SEM 사진(Fig. 7(a))에서 볼 수 있듯이, 일정한 큰 상호 연결된 공극을 가지며 잘 정의된 구조를 보여 주었고, 구조화된 인공지지체의 표면상에서 대공극(Macropores)을 가졌다. 세라믹 인공지지체는 Fig. 7(b)와 같이 Ca 및 P 이온과 같은 화학 성분을 나타내었다. 이러한 구성 요소는 실제 인간의 뼈와 비교하여 유사한 화학적 특성을 갖기 때문에 뼈 조직 재생에 좋은 세포들간의 상호작용 효과를 제공한다.23
3.3 PM, PMSV, PMSVE 몰드에 따른 바이오 세라믹 인공지지체의 형상 및 특성에 관한 비교분석
Table 2는 제작된 인공지지체의 외부 치수, 중량, 체적, 다공성, 그리고 수축량에 대한 계산한 값을 나타낸다.

Measurements of exterior scaffold dimensions and weight and calculated values for volume, porosity, and shrinkage. Values are expressed in average ± SD (n = 8)
본 연구에서는 면 방향에 따른 세라믹 인공지지체 제작의 정확성 및 재현성이 요구된다. 편차가 평균에 가깝다면, 재현성 높게 만들어졌다고 말할 수 있다. PMSVE 세라믹 인공지지체의 치수, 부피 및 수축값이 PM, PMSV 세라믹 인공지지체보다 전체적으로 높다.
PM, PMSV, PMSVE 몰드에 똑같은 양의 세라믹 슬러리를 주입하였을 때 만들어지는 인공지지체의 개수에 차이점을 보였다. 특히 세라믹 슬러리를 손으로 압출하여 만드는 PM, PMSV 몰드의 경우 5, 6개의 몰드가 충진되는 반면에 책상용 압축시험기를 이용한 PMSVE 몰드의 경우 7개에서 최대 10개까지 충진이 되었다. 이러한 이유는 PM, PMSV 몰드가 세라믹 슬러리를 충진하는데 수작업으로 진행되고 일정한 양의 세라믹 슬러리가 몰드 속으로 충진되지 못하며, 일정한 압력을 가지지 못한 채 충진되기 때문에 결과적으로 세라믹 슬러리가 정형적으로 나오지 못한다. 반면, PMSVE 몰드는 책상용 압축시험기를 통해 일정한 압력과 속도로 세라믹 슬러리를 토출하기 때문에 수작업으로 수행하게 되는 PM, PMSV 몰드보다는 보다 많은 몰드에 충전할 수 있고, 세라믹 슬러리가 정형적으로 나온다고 볼 수 있다. 이러한 점을 보았을 때, 똑같은 세라믹 슬러리를 만들었을 때 PMSVE 몰드를 사용하는 것이 반복성이 좋으며, 정형적이고 일정한 인공지지체를 만들 수 있다.
무게와 다공성 값에는 큰 차이가 없었다. 하지만 PM, PMSV 세라믹 인공지지체는 입구가 열려있고 슬러리를 손으로 압출하기 때문에 슬러리를 충진하는 과정 및 소결하는 과정에서 정밀도가 PMSVE 보다 낮다고 판단되었다. Table 2에 Dimension값을 보면 PM, PMSV로 만든 인공지지체는 PMSVE로 만든 인공지지체 보다 값들이 일정하지 못하고 오차 또한 PMSVE로 만든 인공지지체들 보다 높게 측정되었다. 이는 몰드가 열려있는 과정에서 소결하게 되면 열에 쉽게 노출되고 변형도 빠르게 발생하기 때문이다.
Table 3은 PMSVE 인공지지체의 평면 및 방향에 따른 공극 크기의 현미경 측정 결과를 나타낸다. X-Y 평면의 X, Y 방향의 공극 크기는 각각 516 ± 22, 534 ± 28로 측정되었다. X-Z 평면의 X와 Z 방향은 883 ± 40와 538 ± 27로 측정되었다. Y-Z 평면의 Y 및 Z 방향은 각각 557 ± 27 및 917 ± 25로 측정되었다.
4. 결론
본 연구에서는 FDM 3D 프린터를 활용하여 세라믹 인공지지체 몰드 공정을 개발하였다. 그리고 PMSVE 인공지지체를 성공적으로 제작하였고 PM과 PMSV에 대한 결과를 비교하여 다음과 같은 결론을 얻었다.
(1) FDM 3D 프린팅 기술과 압출 성형 방법의 결합은 세라믹 인공지지체 제작공정의 단순화 및 제작시간을 단축시키는 획기적인 기술이었다.
(2) 하부 양측의 4개의 출구를 이용한 몰드는 바이오 세라믹 슬러리 재료의 정량적인 충진으로 인해 인공지지체 제작의 반복재현성을 향상시켰다.
(3) 소결된 세라믹 인공지지체는 CSE공정이 상호 연결된 공극을 가진 정확한 인공지지체 형태를 생성 할 수 있으며 잠재적으로 골 유착에 적합하다는 것을 보여 주었으며 더 나아가 골 조직공학을 위한 적절한 인공지지체를 제작할 수 있는 잠재력을 보여주었다.
향후 연구계획으로는 세라믹 인공지지체의 치수와 평면 및 방향에 따른 공극 크기의 오차를 최소화 할 것이다. 그리고 기계적 강도 향상 및 CSE공정에 따른 다양한 생체재료를 접목한 인공지지체 개발에 초점을 두어 연구를 진행할 계획이다.
Acknowledgments
이 논문은 안동대학교 기본연구지원사업에 의하여 연구되었음.
REFERENCES
-
Thavornyutikarn, B., Chantarapanich, N., Sitthiseripratip, K., Thouas, G. A., and Chen, Q., “Bone Tissue Engineering Scaffolding: Computer-Aided Scaffolding Techniques,” Progress in Biomaterials, Vol. 3, Nos. 2-4, pp. 61-102, 2014.
[https://doi.org/10.1007/s40204-014-0026-7]

-
Zorlutuna, P., Vrana, N. E., and Khademhosseini, A., “The Expanding World of Tissue Engineering: The Building Blocks and New Applications of Tissue Engineered Constructs,” IEEE Reviews in Biomedical Engineering, Vol. 6, pp. 47-62, 2013.
[https://doi.org/10.1109/RBME.2012.2233468]

- Chen, Q., Roether, J., and Boccaccini, A., “Tissue Engineering Scaffolds from Bioactive Glass and Composite Materials,” Topics in Tissue Engineering, Vol. 4, No. 6, pp. 1-27, 2008.
-
Navarro, M., Michiardi, A., Castano, O., and Planell, J., “Biomaterials in Orthopaedics,” Journal of the Royal Society Interface, Vol. 5, No. 27, pp. 1137-1158, 2008.
[https://doi.org/10.1098/rsif.2008.0151]

- Kim, M. S., Kim, H. K., Ji, M. H., and Cho, Y. S., “Mechanical Properties of Scaffolds Used in Tissue Engineering,” Journal of the Korean Society of Mechanical Engineers, Vol. 52, No. 12, pp. 49-53, 2012.
-
Quinn, G. D., Patel, P. J., and Lloyd, I., “Effect of Loading Rate Upon Conventional Ceramic Microindentation Hardness,” Journal of Research of the National Institute of Standards and Technology, Vol. 107, No. 3, pp. 299-306, 2002.
[https://doi.org/10.6028/jres.107.023]

-
Do, A. V., Khorsand, B., Geary, S. M., and Salem, A. K., “3D Printing of Scaffolds for Tissue Regeneration Applications,” Advanced Healthcare Materials, Vol. 4, No. 12, pp. 1742-1762, 2015.
[https://doi.org/10.1002/adhm.201500168]

-
Miranda, P., Saiz, E., Gryn, K., and Tomsia, A. P., “Sintering and Robocasting of β-Tricalcium Phosphate Scaffolds for Orthopaedic Applications,” Acta Biomaterialia, Vol. 2, No. 4, pp. 457-466, 2006.
[https://doi.org/10.1016/j.actbio.2006.02.004]

-
Du, D., Asaoka, T., Shinohara, M., Kageyama, T., Ushida, T., et al., “Microstereolithography-Based Fabrication of Anatomically Shaped Beta-Tricalcium Phosphate Scaffolds for Bone Tissue Engineering,” BioMed Research International, Vol. 2015, pp. 1-9, 2015.
[https://doi.org/10.1155/2015/859456]

-
Sabree, I., Gough, J., and Derby, B., “Mechanical Properties of Porous Ceramic Scaffolds: Influence of Internal Dimensions,” Ceramics International, Vol. 41, No. 7, pp. 8425-8432, 2015.
[https://doi.org/10.1016/j.ceramint.2015.03.044]

-
Chopra, K., Mummery, P., Derby, B., and Gough, J., “Gel-Cast Glass-Ceramic Tissue Scaffolds of Controlled Architecture Produced Via Stereolithography of Moulds,” Biofabrication, Vol. 4, No. 4, pp. 1-12, 2012.
[https://doi.org/10.1088/1758-5082/4/4/045002]

-
Seol, Y.-J., Kim, J. Y., Park, E. K., Kim, S.-Y., and Cho, D.-W., “Fabrication of a Hydroxyapatite Scaffold for Bone Tissue Regeneration Using Microstereolithography and Molding Technology,” Microelectronic Engineering, Vol. 86, Nos. 4-6, pp. 1443-1446, 2009.
[https://doi.org/10.1016/j.mee.2009.01.053]

-
Guo, D., Xu, K., and Han, Y., “The in Situ Synthesis of Biphasic Calcium Phosphate Scaffolds with Controllable Compositions, Structures, and Adjustable Properties,” Journal of Biomedical Materials Research Part A, Vol. 88, No. 1, pp. 43-52, 2009.
[https://doi.org/10.1002/jbm.a.31844]

-
Woesz, A., Rumpler, M., Stampfl, J., Varga, F., Fratzl-Zelman, N., et al., “Towards Bone Replacement Materials from Calcium Phosphates Via Rapid Prototyping and Ceramic Gelcasting,” Materials Science and Engineering: C, Vol. 25, No. 2, pp. 181-186, 2005.
[https://doi.org/10.1016/j.msec.2005.01.014]

-
Bose, S., Darsell, J., Kintner, M., Hosick, H., and Bandyopadhyay, A., “Pore Size and Pore Volume Effects on Alumina and TCP Ceramic Scaffolds,” Materials Science and Engineering: C, Vol. 23, No. 4, pp. 479-486, 2003.
[https://doi.org/10.1016/S0928-4931(02)00129-7]

-
Wilson, C., De Bruijn, J. D., Van Blitterswijk, C., Verbout, A., and Dhert, W., “Design and Fabrication of Standardized Hydroxyapatite Scaffolds with a Defined Macro Architecture by Rapid Prototyping for Bone Tissue Engineering Research,” Journal of Biomedical Materials Research Part A, Vol. 68, No. 1, pp. 123-132, 2004.
[https://doi.org/10.1002/jbm.a.20015]

-
Wilson, C., Van Blitterswijk, C., Verbout, A., Dhert, W., and De Bruijn, J. D., “Scaffolds with a Standardized Macro-Architecture Fabricated from Several Calcium Phosphate Ceramics Using an Indirect Rapid Prototyping Technique,” Journal of Materials Science: Materials in Medicine, Vol. 22, No. 1, pp. 97-105, 2011.
[https://doi.org/10.1007/s10856-010-4183-5]

-
Schumacher, M., Deisinger, U., Detsch, R., and Ziegler, G., “Indirect Rapid Prototyping of Biphasic Calcium Phosphate Scaffolds as Bone Substitutes: Influence of Phase Composition, Macroporosity and Pore Geometry on Mechanical Properties,” Journal of Materials Science: Materials in Medicine, Vol. 21, No. 12, pp. 3119-3127, 2010.
[https://doi.org/10.1007/s10856-010-4166-6]

-
Vivanco, J., Aiyangar, A., Araneda, A., and Ploeg, H.-L., “Mechanical Characterization of Injection-Molded Macro Porous Bioceramic Bone Scaffolds,” Journal of the Mechanical Behavior of Biomedical Materials, Vol. 9, No. pp. 137-152, 2012.
[https://doi.org/10.1016/j.jmbbm.2012.02.003]

-
Sa, M.-W. and Kim, J. Y., “Fabrication and Evaluation of 3D β-TCP Scaffold by Novel Direct-Write Assembly Method,” Journal of Mechanical Science and Technology, Vol. 29, No. 12, pp. 5369-5376, 2015.
[https://doi.org/10.1007/s12206-015-1138-2]

-
Ryu, H.-S., Youn, H.-J., Hong, K. S., Chang, B.-S., Lee, C.-K., et al., “An Improvement in Sintering Property of β-Tricalcium Phosphate by Addition of Calcium Pyrophosphate,” Biomaterials, Vol. 23, No. 3, pp. 909-914, 2002.
[https://doi.org/10.1016/S0142-9612(01)00201-0]

- Sa, M.-W. and Kim, J. Y., “A Study on Fabrication of 3D Scaffolds Using Bio-Ceramic Fabrication System Based on Solid Free-Form Fabrication Technique,” Tissue Engineering and Regenerative Medicine, Vol. 10, No 2. pp. 56-61, 2013.
-
Daculsi, G., Passuti, N., Martin, S., Deudon, C., Legeros, R., et al., “Macroporous Calcium Phosphate Ceramic for Long Bone Surgery in Humans and Dogs. Clinical and Histological Study,” Journal of Biomedical Materials Research, Vol. 24, No. 3, pp. 379-396, 1990.
[https://doi.org/10.1002/jbm.820240309]


Research Institute Director in Research Institute, SJ TOOLS. His research interest is development of cutting tools and fabrication of various 3D scaffolds for bone tissue engineering using rapid prototyping (RP).
E-mail: 79smw42@gmail.com

B.Sc. candidate in the Department of Mechanical Engineering, Andong National University. His research interest is in the design and fabrication of various 3D scaffolds for bone tissue regeneration using rapid prototyping (RP) technique.
E-mail: ssample9428@gmail.com

Professor in the Department of Mechanical Engineering, Andong National University. His research interest is in the design of biomimetic scaffold and development of rapid prototyping (RP) system for bone tissue regeneration.
E-mail: jykim@anu.ac.kr