소독제를 탑재한 키토산 마이크로 비드 정밀 제조공정과 살 바이러스 효능평가
Copyright © The Korean Society for Precision Engineering
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study examines the efficiency of chitosan microbeads in manufacturing and their effectiveness as a disinfectant. The microbeads are developed using a solvent-assisted extraction process. The manufacturing process involves crosslinking chitosan through an emulsion-based method, with the help of a crosslinker. This leads to an increase in particle size while maintaining homogeneity and dispersion. The solvent-assisted method, which utilizes acetone, effectively extracts the crosslinked beads into the aqueous phase. This extraction process ensures the structural stability of the beads, with an average particle size of 40±3.94 μm. By incorporating the disinfectant agent into the chitosan beads, antiviral effects against the Porcine Reproductive and Respiratory Syndrome Virus (PRRSV) were observed. These effects were found to be effective at dilutions estimated to be between 1 : 1 and 1 : 100. The findings of this study demonstrate the inherent antiviral capabilities of chitosan beads and the enhanced impact when combined with the disinfectant. This suggests a synergistic approach to managing viral infections in livestock environments.
Keywords:
Disinfectant, Viral killing efficacy, Chitosan, Microbead, Solvent assisted extraction process키워드:
소독제, 살 바이러스 효능, 키토산, 마이크로 비드, 용매 추출 공정1. 서론
전 세계적으로 기후 위기로 인한 농경지의 감소로 식량안보의 중요성이 크게 대두되고 있으며 그중에서도 축산업은 지속 가능한 식량 공급원으로서 중요한 역할을 하고 있다. 우리나라도 닭, 돼지와 달리 소고기의 경우 식량자급률이 40% 미만으로 식량안보 차원에서 첨단 축산업 육성이 시급함에 따라 축사 내부의 위생 상태 악화로 발생하는 가축 질병의 관리는 매우 중요한 국가적 과제이다. 한번 전염성 가축 질병이 발생하면, 확산을 막기 위해 가축들의 살 처분 및 이동제한으로 인해, 육류와 계란 등 공급 부족으로 인한 가격 폭등과 급격한 소비위축으로 인해 상당한 경제적 손실이 발생하기도 한다.
대표적인 전염성 가축질병으로 돼지 생식기 호흡기 증후군 바이러스(Porcine Reproductive and Respiratory Syndrome Virus, PRRSV), 조류 인플루엔자(Avian Influenza, AI), 구제역(Foot-and-Mouth Disease, FMD), 그리고 살모넬라(Salmonella)와 같은 다양한 바이러스 및 세균성 전염병은 축산업에 심각한 경제적 손실을 초래하며, 이를 방제하기위한 다양한 방법 중 효과적인 소독제의 개발이 지속적으로 요구되고 있다[1,2].
현재 축사에 기본적으로 사용되는 소독제는 대부분 액상 형태로 분무기를 이용 분사를 통해 축사 내부를 소독하거나, 이동하는 차량 바퀴가 잠기는 액상 방식으로 소독을 하고 있다. 이러한 방법은 단기적인 효과는 뛰어나지만 지속적인 효과를 얻기 위해서는 1주일에 1번 이상은 방역 활동이 필요하기 때문에 과도한 소독제 사용으로 인한 수질 및 토양 환경오염, 근로자의 안전성 문제와 경제적인 부담도 크게 발생한다[3,4]. 따라서 소독 효능을 1회성이 아닌 장기적으로 지속할 수 있는 약물 방출 시간을 조절할 수 있는 다양한 전달체 제조 방법의 연구가 활발히 이루어지고 있다[5].
이 중에, 키토산 생분해성 폴리머를 이용한 필름이나 입자들은 환경 친화성과 함께 서서히 분해되는 서방형 성질과 함께 항바이러스 및 항균 효능이 보고됨에 따라 소독제로서 활용가능성을 주목받고 있다[6]. 키토산, 알지네이트, 전분, 셀룰로오스 같은 천연물 유래 생분해성 고분자 소재들은 친환경 소재로 서서히 분해되는 특성으로 인해 많은 산업분야에 활용되고 있으며, 특히 키토산은 양이온성 물질로 미생물 세포표면의 음이온과 강력한 반응을 하여 세포내 물질을 파괴하는 항균, 살균 효능으로 주목을 받으면서 다양한 산업 분야에서 널리 활용되고 있다[7].
본 연구는 키토산을 이용 마이크로 비드를 제조하고 이들 내부에 상용화된 소독제를 탑재하여, 소독성분이 마이크로 비드내에서 방출되면서 바이러스를 죽이는 효능을 기존 액상 소독제와 비교 평가를 하고자 한다. 특히, 소독제를 탑재하기 위한 키토산 마이크로비드를 균일한 크기로 대량 생산을 위한 공정을 개선하기 위해 W/O 에멀전 키토산 용액을 다양한 가교제를 이용 가교 결합을 유도하고, 가교제에 따라 입자의 크기와 분산성에 미치는 영향에 대해 조사하였다. 또한 제조된 입자를 빠르게 유기상으로부터 분리하기 위해 아세톤을 사용한 Solvent-assisted 추출 공정을 통해 구조적으로 안정된 키토산 마이크로 비드를 효과적으로 분리, 추출하는 방법을 제시하였다. 마지막으로 소독제 탑재 키토산 마이크로 비드가 친환경 소독제로써 사용 가능성을 평가하기 위해 이들의 살 바이러스 특성과 소독제 원액과의 비교를 통해 효능을 확인하였다. 본 결과는 향후 스마트 축사 개발에 있어서 전염성 질병 관리를 위한 친환경 지속형 소독제로 활용 가능할 것으로 기대된다.
2. 실험방법
2.1 키토산 에멀전 용액을 이용한 마이크로 비드 제조
마이크로 비드를 제조하기 전 단계로 키토산 에멀전 제조를 위하여 2% (w/w) 키토산 (1.250 kDa)을 1% 아세트산 수용액에 녹인 후 8시간 동안 교반 하였다. 그리고 미네랄 오일에 계면활성제인 5% (w/w) Span80을 첨가한 후 균일하게 혼합하였다. 제조한 키토산 용액과 미네랄 오일을 1 : 10 부피비율로 혼합한 다음 1 h 동안 1,000 RPM 속도로 교반 하면서 균일한 W/O 에멀전 용액을 제조하였다. 다음은 가교제로 1% (w/v) GLU (Glutaraldehyde) 용액과 키토산 에멀젼 용액을 동일한 부피로 혼합하고 30분간 교반반응을 통해 키토산 에멀전 용액의 가교결합을 유도 마이크로 비드를 제조하였다.
소독액을 탑재한 키토산 마이크로 비드는 키토산 에멀전 제조공정에서 소독원액 (SILLIS SHIELD DK, ㈜엘브스케미칼) 용액과 D.W를 1 : 1 부피비율로 혼합한 용매에 키토산을 같은 농도로 녹여서 제조하였으며, 위와 동일한 공정조건으로 키토산 에멀전 용액을 제조하고, 가교결합을 통해 소독제 원료를 탑재한 키토산 마이크로 비드를 제조하였다.
2.2 키토산 마이크로 비드 추출 및 건조 공정
솔벤트를 이용한 비드의 추출 공정은 다음과 같이 진행되었다. 가교결합 반응을 시킨 키토산 W/O 에멀전 용액에 미네랄 오일과 동량의 30% 아세톤 용매를 첨가한 후 1 h 동안 1,000 RPM에서 교반하여 첨가된 아세톤 용매가 수상과 유기상 양쪽에 균일하게 분산되도록 유도하였다. 충분한 교반을 거친 후 상온에 20-30분간 정치한 다음 상분리를 유도하고, 최종적으로 대부분의 키토산 마이크로 비드가 수상으로 이동한 다음 상층부의 유기상 용매를 제거하였다. 유기상 용매를 제거 후 남아있는 수상을 추가로 제거하고, 20% 에탄올을 이용 추출한 키토산 마이크로 비드를 3회 이상 세척한 다음 마이크로 비드를 상온에서 건조하였다. 소독액을 탑재한 키토산 마이크로 비드 역시 동일 공정으로 추출 및 건조하였다.
2.3 키토산 마이크로 비드 소독제 효능 시험
키토산 마이크로 비드의 효능 시험을 위해 PRRSV를 MARC-145 세포주를 활용 배양하였으며, 바이러스 배양 과정에서 활성이 높은 바이러스를 선별하였으며, 적정 증식 시점에서 채취한 다음 얼음물에 단기간 보관한 다음 효능평가를 위해 4oC에서 보관된 바이러스와 희석용액과 10분 간격으로 희석배율별 혼합한 후 30분 동안 반응을 진행시켰다. 그리고 중화반응 단계에서는 소독제의 효능을 중화하기 위해 혼합액을 37oC의 중화배지에 접종하여 바이러스 함량을 측정하였다. 바이러스 감염력 상실 정도는 Microplate Titration과 Plaque Assay 를 이용하여 확인하였으며, 발육란을 이용한 시험에서는 5일간 37oC에서 배양하여 바이러스의 증식을 검사하였다. 바이러스 함유량은 Kaerber Method를 사용하여 계산하였으며, 소독제가 없는 키토산 마이크로 비드를 대조군으로 설정 실험을 진행 바이러스의 역가가 적정 수준인지 확인하였다[8,9]. 바이러스 감소율은 아래의 방법으로 계산하였다.
| (1) |
- A : Number of Viable Virus before Treatment
- B : Number of Viable Virus after Treatment
3. 결과 및 고찰
3.1 키토산 마이크로 비드의 가교 결합
Solvent-assisted 공정을 이용한 키토산 마이크로 비드의 대량 추출 과정은 유기상(Oil Phase) 내 W/O 에멀전에서 키토산 액적의 가교 결합 유도 공정으로부터 시작된다. 기계적 교반을 통해 W/O 키토산 에멀전을 제조한 후, 유기상 내에서 가교제인 GLU의 첨가로 키토산 에멀젼 크기변화와 균일하게 에멀젼 용액으로부터 가교결합 반응이 일어나는지를 확인하였다. 제조된 키토산 에멀전 입자는 38.08±7.48 μm크기로, 균일한 입자분포를 보여주고 있다(Fig. 1 (a)). GLU 첨가 후 충분한 시간동안 기계적 교반을 한 다음 생성된 입자의 크기를 측정한 결과, 50.58±7.73 μm로 입자의 크기가 증가하였고, Fig. 1(b)의 히스토그램을 통해 입자의 분포가 GLU첨가 전 후 수평적으로 이동하였음을 확인할 수 있다.
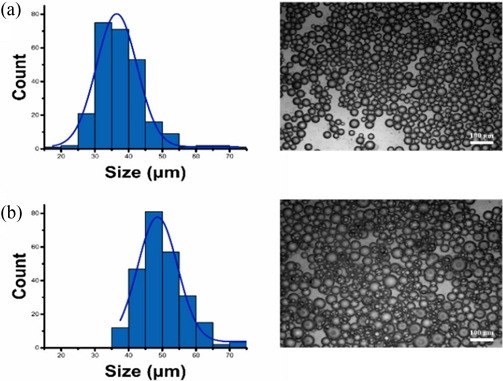
(a) The size of the CS emulsion and (b) the change in size of the emulsion after the injection of the crosslinking agent (Scale bar = 100 μm)
이를 통해 교반 과정을 거치면서 가교결합 용액이 일정한 비율로 키토산 에멀젼 입자들과 효과적으로 결합했다고 유추할 수 있다.
3.2 Solvent-assisted 키토산 비드 추출 공정
기존 연구들은 가교결합 비드를 유기상에서 분리하기 위한 다양한 연구를 수행하였다. 대표적인 예로는 원심분리를 이용한 추출 방법이 있으며[10,11], 미세유체 소자를 활용 오일과 비드를 추출하는 방법들이 보고되고 있다[12]. 이들 방식의 단점은 대량으로 오일과 비드를 분리하기가 어려운 산업적으로 활용할 수 있는 양산성이 떨어진다는 것이다. 여기서는 이런 단점을 극복하고 추출 효율을 향상시키기 위하여 유기용매를 활용한 추출 공정을 수행하였다. 유기용매를 활용하면 수상과 유상의 계면에서 작용하는 표면 장력을 최소화시켜[13], 수상과 유기상계면으로 이동하는 가교결합 된 키토산 마이크로 비드가 수상으로 이동을 유도하게 된다. 다양한 유기용매를 활용한 실험을 진행한 결과, 추출 효율이 가장 높은 유기용매로 아세톤을 사용하였으며, Fig. 2에서 확인할 수 있듯, 마이크로 비드가 하부에 있는 수상으로 대부분 침전되면서 성공적으로 추출이 가능함을 확인할 수 있었다.
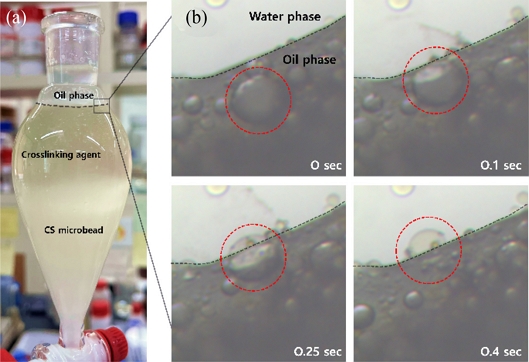
Process of the Solvent-driven CS microbead extraction. (a) The image of fully extracted CS microbead and (b) The image of detailed process of CS microbead extraction (Scale bar = 100 μm, Black dotted line = Oil-water interface, Red dotted line = Crosslinked CS microbead)
좀 더 자세하게 계면에서 일어나는 현상을 살펴보면 Fig. 2(b)에서 시간에 따라 유기상에서 수상으로 마이크로 비드가 이동하는 모습을 명확히 관찰할 수 있었다. 현미경 이미지를 통해 비드가 유기상에서 수상으로 완전히 이동하기까지의 계면의 변화를 상세히 관찰하였다. 이미지들은 마이크로 비드가 유기상에서 수상으로 이동하는 과정을 시간순으로 보여주고 있으며, 표면 장력이 감소함에 따라 마이크로 비드가 유기상-수상 계면을 통과하는 모습을 단계적으로 보여준다. 이때 이동에 걸리는 시간은 1.0 s 미만으로 매우 빠른 속도로 계면을 통해 이동하는 것을 알 수 있었다.
Fig. 3은 추출 및 세척 후 키토산 마이크로 비드의 사이즈와 균일도를 분석한 결과를 보여준다. 추출 과정을 거친 후, 현미경으로 관찰한 결과, 키토산 마이크로 비드는 키토산 에멀젼과 마찬가지로 구형 형태를 유지하고 있는 것을 확인하였다. 이 결과는 추출 공정과정이 키토산 마이크로 비드의 구조적 안정성에 영향을 미치지 않음을 보여준다. 최종적으로 제조된 마이크로 비드의 평균 사이즈는 기존 키토산 에멀전과 비교해서 40±3.94 μm로 약간 줄어든 것을 확인하였다(Fig. 3). 이 결과는, 키토산 폴리머와 가교제가 결합하여 키토산 하이드로겔 메트릭스를 형성하면서 내부에 있는 물 분자가 방출되면서 겔이 수축 되었기 때문이다[14-16].
3.3 소독제 탑재 키토산 마이크로 비드 특성
액상 소독제가 장시간 동안 서서히 방출할 수 있는 효능을 가지는 분말형 소독제를 제조하기 위해, 주로 축사의 바이러스 감염예방에 사용되는 소독 원액 용액을 키토산 에멀젼 제조공정에 함께 혼합한 다음, 가교 공정 및 아세톤을 이용한 Solvent-assisted 추출 공정을 통해 소독제 탑재 키토산 마이크로 비드를 제조하였고, 분말화는 상온에서 자연 건조를 실시하였다. 광학 및 SEM 이미지는 건조 과정에서 수분이 증발하면서 제조된 키토산 마이크로 비드가 수축되면서 크기가 줄어드는 현상을 확인하였으며, 이때 입자의 균일도는 SEM 이미지에서 보는 것 처럼 큰 영향을 미치지 않는 것을 확인하였다(Figs. 4(a) 및 4(b)).

The (a) optical image (Scale bar = 100 μm) and (b) SEM image (Scale bar = 40 μm) of dried CS microbead
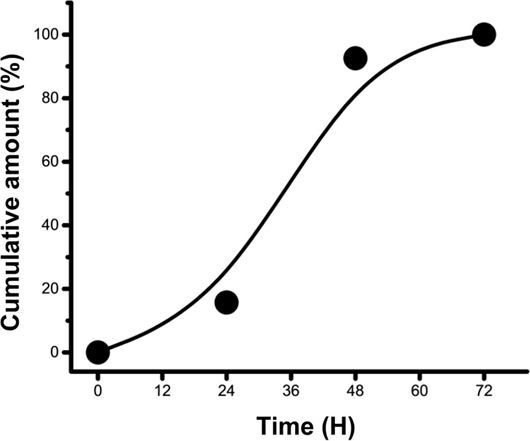
한편, 소독제가 탑재된 키토산 마이크로 비드에서 소독제의 방출 특성을 관찰하기 위해 분말화된 소독제 탑재 마이크로 비드를 D.W에 분산시킨 다음 시간에 따른 소독제 성분의 방출거동을 측정하였다. 방출 특성은 소독제 원액의 주요 성분인 구연산(Citric Acid)을 HPLC로 표준 검량 곡선을 구한 다음 D.W 수용액에서 시간에 따른 방출되는 구연산을 HPLC를 이용 정량적으로 측정하였다. Fig. 5는 소독제가 탑재 된 키토산 마이크로 비드로부터 구연산 성분이 초기 24시간 동안 서서히 방출되다가, 48시간까지 방출 속도가 빨라지면서 방출량이 거의 90% 정도가 되며, 다음 72시간까지는 서서히 방출 속도가 느려지면서 탑재된 소독제 성분이 거의 대부분 방출되는 것을 알 수 있었다. 이런 결과는 소독제 탑재 키토산 마이크로 비드 분말이 일정 수준의 서방성을 보여주었음을 시사한다.
3.4 소독제 탑재 키토산 마이크로 비드의 살 바이러스 효능 평가
소독제 탑재 키토산 마이크로 비드를 이용한 살 바이러스 능력을 평가하기 위해, 돼지 생식기 호흡기 증후군 바이러스(PRRSV)를 대상으로 실험을 진행하였다. 본 연구에 사용한 바이러스는 북미 유전형(Genotype 1)에 속하며, GenBank에 등록번호 JN315685로 등록된 바이러스를 사용하였다. 세포의 감염 여부를 확인하기 위해 배양에 사용된 세포주는 MARC-145를 사용하였다. 살 바이러스 효과실험에 적용한 바이러스의 농도는 TCID50/mL 단위로 2.84 × 105로 설정되었으며, 이는 배양된 세포의 50%가 바이러스에 의해 감염되는 농도를 나타낸다. 국립수의과학검역 검사본부가 제시하는 소독제 효능 평가 표준 방법에 따르면, 소독제의 효능을 인정받기 위해서는 처리 후 바이러스가 최소 1.00 × 104 단위 이상 감소해야 하며, 이는 소독제 처리 후 바이러스의 농도가 기준치인 2.84 × 10 이하로 확인될 때 소독제가 살 바이러스 효능이 있다는 것을 의미한다. 본 실험은 소독제를 탑재한 키토산 마이크로 비드 분말을 물에 수화 시킨 용액과 소독제 원액을 일정 농도로 희석한 용액을 이용하였다. 소독제 원액 및 희석 용액과 소독제 탑재 키토산 마이크로 비드 분말을 D.W에 20%(w/v)으로 수화 시킨 샘플 용액을 제조하였다. 바이러스 감소율 기준으로 소독제를 탑재한 키토산 마이크로 비드가 PRRSV에 효과를 보이기 위해서는 바이러스 감소율이 99.99% 즉 거의 대부분 소멸 되어야 한다.
소독제 원액 용액의 경우 희석배수 1 : 1, 1 : 50까지 바이러스가 사멸되는 효능을 보였지만, 1 : 100으로 희석한 경우 바이러스 사멸되기는 하지만, 99.99% 까지 사멸 효과는 없었다. 따라서 소독제 원액의 경우 살 바이러스 유효 농도는 1 : 50과 1 : 100 사이 희석배수에서 사용할 수 있다(Table 1).
반면 소독제를 탑재한 키토산 마이크로 비드의 경우 희석배수 1 : 100까지 100%의 살 바이러스 효과를 보여주고 있으며 소독제로서 기준치를 충족하는 것으로 나타났다(Table 2). 하지만, 희석배수 1 : 300에서는 바이러스 사멸 효과가 99.97%로 관찰되고 소독제로서 효능 기준치에는 도달하지 못함을 확인하였다. 이 결과는 소독제 탑재 키토산 마이크로 비드의 최적 유효농도는 희석배수 1 : 100과 1 : 300 사이임을 확인할 수 있었다. Fig. 6은 배양된세포가 소독제 처리로 인해, 바이러스로부터 얼마나 보호 될 수 있는지를 보여주고 있다. Fig. 6(a)는 정상적인 MARC-145세포가 잘 성장함을 보여주고 있으면, Fig. 6(b)는 PRRSV를 처리하면 이미지에서 볼 수 있는 것처럼 세포들이 사멸되어 뭉쳐있는 것을 알 수 있었다. 또한 소독제가 탑재된 키토산 마이크로 비드용액을 각각의 희석배수(1 : 100, 1 : 300)로 처리했을 때 1 : 300에서 세포가 사멸된 것은 소독제의 효과가 없다고 볼 수 있다. 하지만, 원액보다 살 바이러스 효능이 향상된 것은 소독제 원료뿐만 아니라 키토산 자체가 가지는 향균, 살바이러스 특성 때문에 이를 마이크로 비드로 제조함으로써 소독효능을 증가시킬 수 있었다고 보인다. 또한 소독제가 서서히 방출함으로써 장기간 소독제의 효과를 극대화 시키는 데 있어서 큰 장점이 있을 것으로 판단된다.
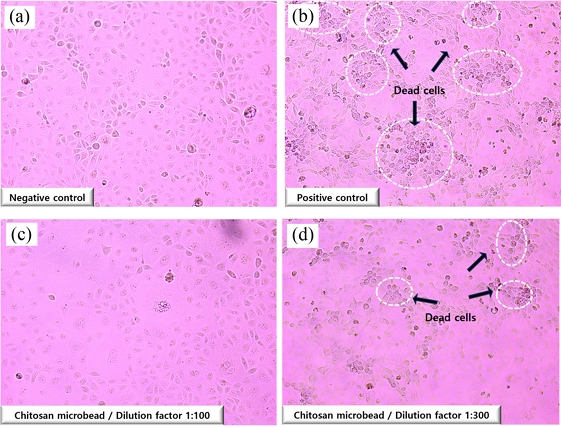
Microscopic observations of MARC-145 cells under different experimental conditions: (a) Negative control group with untreated MARC-145 cells showing normal morphology, (b) Positive control group with MARC-145 cells exposed to PRRSV showing cytopathic effects, (c) MARC-145 cells treated with the chitosan microbead encapsulation with disinfectant at a 1 : 100 dilution demonstrating reduced viral cytopathic effects, and (d) MARC-145 cells treated with the chitosan microbead encapsulation with disinfectant at a 1 : 300 dilution showing intermediate levels of viral cytopathic effects
4. 결론
본 연구는 유기상과 수상에서 상 이동 현상을 이용한 Solvent-assisted 추출 공정이 효율적으로 소독제가 탑재된 키토산 마이크로 비드를 빠른 속도로 분리 가능함을 보여주고 있다.
키토산 하이드로겔을 제조하기 위해 첨가한 가교제는 에멀젼 입자의 크기를 증가시켰으나, 마이크로 비드의 균일도는 크게 변함이 없었다. 또한, 최종 마이크로 비드를 대량으로 생산하기 위해 아세톤을 이용한 Solvent-assisted 추출 공정을 통해 마이크로 비드의 구조를 유지함과 동시에 빠른 시간 안에 소독제 탑재 마이크로 비드와 계면에 잔존하는 미네랄오일을 제거할 수 있었다. 이 방법으로 제조된 소독제 탑재 키토산 마이크로 비드의 살 바이러스 효과와 지속성을 확인하였다. 소독 효과는 원액 희석농도 50배 대비 100배로 희석하여도 충분한 살 바이러스 효능을 보여주며, 72시간까지 소독제가 방출하는 지속성도 확인하였다. 향후 추가적 연구를 통해 키토산 분자량에 따른 매트릭스의 구성밀도 조절, 가교제 농도에 따른 치밀도 조절, 마이크로 비드의 크기 등 조절을 통해 소독 효과를 보다 지속시킨 개선된 서방형 소독제 개발이 가능할 것으로 기대한다.
Acknowledgments
본 결과물은 농림축산식품부의 재원으로 농림식품기술기획평가원의 기술사업화지원사업의 지원을 받아 연구되었음(No. 821033-3).
REFERENCES
-
Yadav, M., Singhal, C., Babbar, S., Tanwar, S., Awasthi, S., Pandey, S., Dhyani, S., Joshi, P., Kumar, D., Chauhan, A., Gupta, S., Kumar, N., Dwivedi, R., Chaudhuri, S., (2023), Antibiotics and surface disinfectant induce VBNC and emergence of resistance in hospital-associated pathogens, International Journal of Infectious Diseases 130, S98.
[https://doi.org/10.1016/j.ijid.2023.04.243]

-
Davies, R., Wales, A., (2019), Antimicrobial resistance on farms: a review including biosecurity and the potential role of disinfectants in resistance selection, Comprehensive Reviews in Food Science and Food Safety, 18(3), 753-774.
[https://doi.org/10.1111/1541-4337.12438]

-
Wang, Y., Zhao, H., Huang, L., Chen, G., Wei, Z., Mo, Q., Li, Y., Wang, X., Huang, C., Chen, Q., (2023), Development of chlorine dioxide sustained-release device using carboxymethyl cellulose-polyvinyl alcohol-β-cyclodextrin ternary hydrogel and a new sustained-release kinetic model, Cellulose, 30(5), 3073-3082.
[https://doi.org/10.1007/s10570-023-05070-6]

-
Wang, J., Ding, H., Tao, X., Chen, J., (2007), Storage and sustained release of volatile substances from a hollow silica matrix, Nanotechnology, 18(24), 245705.
[https://doi.org/10.1088/0957-4484/18/24/245705]

-
Myung, N., Kang, H.-W., (2018), Construction of programmable drug delivery system with additive manufacturing, Journal of the Korean Society for Precision Engineering 35(9), 835-840
[https://doi.org/10.7736/KSPE.2018.35.9.835]

-
Motshekga, S. C., Ray, S. S., Maity, A., (2018), Synthesis and characterization of alginate beads encapsulated zinc oxide nanoparticles for bacteria disinfection in water, Journal of Colloid and Interface Science, 512, 686-692.
[https://doi.org/10.1016/j.jcis.2017.10.098]

-
Chandrasekaran, M., Kim, K. D., Chun, S. C., Antibacterial activity of chitosan nanoparticles: A review, Processes, 8(9), 1173.
[https://doi.org/10.3390/pr8091173]

-
Cafruny, W. A., Duman, R. G., Rowland, R. R., Nelson, E. A., Wong, G. H., (2008), Antibiotic-mediated inhibition of porcine reproductive and respiratory syndrome virus (PRRSV) infection: a novel quinolone function which potentiates the antiviral cytokine response in MARC-145 cells and pig macrophages, Virology: Research and Treatment, 1, 17-28.
[https://doi.org/10.4137/VRT.S527]

-
Yim-im, W., Huang, H., Zheng, Y., Li, G., Rawal, G., Gauger, P., Krueger, K., Main, R., Zhang, J., (2022), Characterization of PRRSV in clinical samples and the corresponding cell culture isolates, Transboundary and Emerging Diseases, 69(5), e3045-e3059.
[https://doi.org/10.1111/tbed.14661]

-
Zhang, C., Grossier, R., Candoni, N., Veesler, S., (2021), Preparation of alginate hydrogel microparticles by gelation introducing cross-linkers using droplet-based microfluidics: A review of methods, Biomaterials Research, 25(1), 41.
[https://doi.org/10.1186/s40824-021-00243-5]

-
Zhang, H., Tumarkin, E., Sullan, R. M. A., Walker, G. C., Kumacheva, E., (2007), Exploring microfluidic routes to microgels of biological polymers, Macromolecular Rapid Communications, 28(5), 527-538.
[https://doi.org/10.1002/marc.200600776]

-
Yang, C.-H., Huang, K.-S., Lin, P.-W., Lin, Y.-C., (2007), Using a cross-flow microfluidic chip and external crosslinking reaction for monodisperse TPP-chitosan microparticles, Sensors and Actuators B: Chemical, 124(2), 510-516.
[https://doi.org/10.1016/j.snb.2007.01.015]

-
Nazemi, T., Sadeghi, R., (2014), Effect of polar organic solvents on the surface adsorption and micelle formation of surface active ionic liquid 1-dodecyl-3-methylimidazolium bromide in aqueous solutions and comparison with the traditional cationic surfactant dodecyltrimethylammonium bromide, Colloids and Surfaces A: Physicochemical and Engineering Aspects, 462, 271-279.
[https://doi.org/10.1016/j.colsurfa.2014.09.010]

-
Biernat, M., Woźniak, A., Chraniuk, M., Panasiuk, M., Tymowicz-Grzyb, P., Pagacz, J., Antosik, A., Ciołek, L., Gromadzka, B., Jaegermann, Z., (2023), Effect of selected crosslinking and stabilization methods on the properties of porous chitosan composites dedicated for medical applications, Polymers, 15(11), 2507.
[https://doi.org/10.3390/polym15112507]

-
Gong, J., Schuurmans, C. C. L., van Genderen, A. M., Cao, X., Li, W., Cheng, F., He, J. J., López, A., Huerta, V., Manríquez, J., Li, R., Li, H., Delavaux, C., Sebastian, S., Capendale, P. E., Wang, H., Xie, J., Yu, M., Masereeuw, R., Vermonden, T., Zhang, Y. S., (2020), Complexation-induced resolution enhancement of 3D-printed hydrogel constructs, Nature Communications, 11(1), 1267.
[https://doi.org/10.1038/s41467-020-14997-4]

-
Neto, C. D. T., Giacometti, J. A., Job, A. E., Ferreira, F. C., Fonseca, J. L. C., Pereira, M. R., (2005), Thermal analysis of chitosan based networks, Carbohydrate Polymers, 62(2), 97-103.
[https://doi.org/10.1016/j.carbpol.2005.02.022]


Senior Research in the Research Inst. of Advanced. Materials, Collage of Engineering, Seoul National University. His research interest is nano/micropariticles include synthesis of nano/microparticle through microfluidics systems
E-mail: kkbbss748@snu.ac.kr

Senior Research in the Research Inst. of Advanced. Materials, Collage of Engineering, Seoul National University. His research research focuses on nano/microparticles for biomedical applications, numerical analysis in microfluidics, and MEMS processes
E-mail: chsh1123@snu.ac.kr

Professor of Mechanical Engineering at the Kyungpook National University. His group’s research includes Biomimetics, soft robotics, continuous micro/nano manufacturing technologies, and applications of micro/nano structures based functional surfaces.
E-mail: mkkwak@knu.ac.kr

Research Professor of of Center for Food and Bioconvergence, Department of Food Science and Biotechnologyat Seoul National University. His current research interests are in developing a functional supramolecular structures such as bicelle vesicles and polymeric particle for drug delivery system.
E-mail: jhs@snu.ac.kr